近日,兰州大学生命科学学院张春江教授团队在探究黄芪多糖预防溃疡性结肠炎的调控机制方面取得了研究进展。相关研究成果已发表在国际知名期刊《International Journal of Biological Macromolecules 》(IF= 8.2、一区期刊)上。

人体肠道中寄生着多种多样的微生物,统称为肠道微生物群。在健康状态下,肠道微生物群在新陈代谢、平衡和免疫功能中发挥着至关重要的作用。而肠道微生物群一旦出现紊乱(或称菌群失调),可导致包括炎症性肠病(IBD)在内的各种疾病。此外,肠道微生物群还与关键的代谢途径有关,包括产生短链脂肪酸(SCFAs)和维生素,提供营养和能量。SCFAs是肠道微生物发酵的副产品,对维持肠道菌群平衡、调节免疫系统、减轻炎症和抑制肿瘤细胞生长至关重要。尽管现有IBD治疗方法有效,但副作用明显,会产生恶心、呕吐和腹泻等情况。因此,针对肠道微生物的治疗策略,有望成为预防或治疗IBD的新途径。
膳食多糖作为益生元的重要来源,能为盲肠和结肠微生物群提供能量、调节肠道微生物群,对健康多方面有益,如改善肠道健康、减轻体重、治疗2型糖尿病和抑制非酒精性脂肪性肝炎。研究表明,益生元的益处取决于肠道菌群的组成。
且近期研究指出,壳聚糖、海藻多糖、真菌、细菌和中药等多糖在预防或缓解结肠炎方面具有潜力,尤其是植物多糖。这些多糖具有高效、低毒、天然等特点,具备抗炎、抗氧化和免疫调节等特性,对维持肠道粘膜完整性至关重要。因此,确定和探索植物膳食多糖的有益特性非常重要。
黄芪是一种兼具食品和药物特性的传统中药,含有黄酮、皂苷和生物碱等多种成分,其中黄芪多糖(APS)是其最重要的生物活性化合物。研究表明,黄芪多糖具有治疗溃疡性结肠炎(UC)的潜力,但其具体活性成分和作用机制尚需进一步研究。
在这项研究中,作者通过超滤分离了两种分子量的黄芪多糖(APS)组分,即APS1(Mw < 10 kDa)和APS2(10 kDa< Mw < 50 kDa),重点研究了它们的益生作用、对UC的影响及其潜在机制。结果显示,APS1 和 APS2 都具有益生元特性,其中 APS1 在改善 UC 症状方面明显优于 APS2。APS1 可通过减轻体重和结肠病变、改善肠粘膜屏障的完整性以及调节炎症反应来缓解 UC。此外,APS1还能通过促进有益微生物的生长和增加SCFAs的产生来重新平衡肠道微生物群,从而改善肠道内环境和健康状况。这些发现凸显了 APS1 在治疗 UC 方面的多重作用,从改善肠道屏障功能到调节免疫反应以纠正菌群失调。这些发现不仅加强了 APS1 在治疗应用中的价值,还将 APS1 定位为一种有潜力的益生元制剂,为UC治疗策略提供了新方向。
文章中,为了确定口服 APS1 和 APS2 后是否能进入肠道并被菌群利用,使用博鹭腾AniView系列多模式动物活体成像系统拍摄了它们在小鼠体内的分布情况。
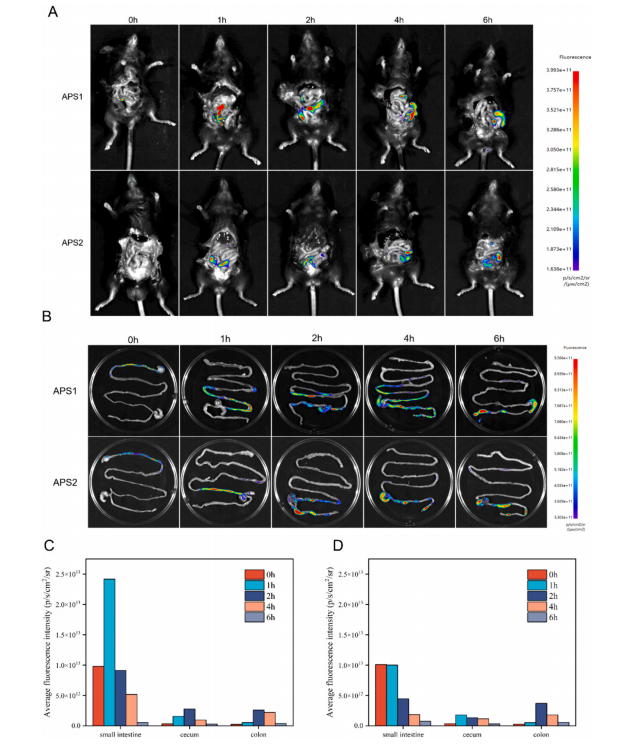
小鼠口服 APS1 或 APS2 6 小时后的时间分布分析
(A) 小鼠的荧光强度图像
(B) 小鼠肠道部位的体外成像
(C) 口服 APS1 6 小时后小肠、盲肠和结肠中荧光的定量分布统计
(D) 口服 APS2 6 小时后小肠、盲肠和结肠中荧光的定量分布统计
论文链接:https://doi.org/10.1016/j.ijbiomac.2024.132580