近日,安徽工业大学化学与化工学院韩新亚老师团队在阿尔茨海默疾病的检测探针开发研究上取得了新进展,相关研究成果已经发表在国际权威期刊《Sensors and Actuators B: Chemical》(IF=8.4、一区期刊)上。

过氧亚硝酸根(ONOOˉ)是一种具有强氧化和硝化能力的活性氧和氮物种(RONS),在生物体系中通过一种快速的扩散控制反应形成,该反应涉及两种自由基——一氧化氮(•NO)和超氧阴离子(O2•-),且不需要酶催化。在正常浓度下,ONOOˉ 能够维持氧化还原平衡,并作为信号分子通过硝化酪氨酸残基来调节神经信号传导途径。然而,ONOOˉ 的过度产生可能导致阿尔茨海默病(AD)中的氧化应激和神经退行性变,继而引起脂质、核酸、酶和蛋白质的结构和功能变化,这被认为是早期AD诊断的潜在生物标记物。
当前,已有多种分析方法被用于检测ONOOˉ,包括电子自旋共振、比色法、电化学、液相色谱-质谱和荧光分析等。其中,荧光分析检测方法因其特异性、灵敏度、非侵入性和实时监测的优势而受到广泛关注,被认为是生物系统中感测和成像ONOOˉ 的理想选择。
迄今为止,许多 ONOOˉ 荧光探针都是依靠不同的反应模式开发出来的,例如硫化物的氧化、硼酸或硼酸酯的氧化、C-C双键的断裂、氧化性N-脱芳基化等,但ONOOˉ 荧光探针在实际应用中仍存在一些挑战:(1)ONOOˉ 与其质子化形式ONOOH(pKa = 6.8)处于平衡状态,在生物体系中半衰期极短(约10毫秒),需要探针具有超快的响应速度以满足实时监测的需求;(2)探针必须具有良好的水溶性和低毒性,才适合在复杂的生物体系中应用;(3)探针需要对ONOOˉ 具有高度选择性,以避免其他ROS/RNS的干扰,尤其是与ONOOˉ反应性类似的H₂O₂;(4)探针应具有大的斯托克斯位移和长波长发射的特点,以满足AD模型中高分辨率和深层成像的需求;(5)在AD大脑中成像ONOOˉ需要探针能够穿透血脑屏障(BBB)。
在本研究中,作者设计并合成了两种新型荧光探针NBD-Y和NBD-I,它们利用ONOOˉ 氧化断裂C-N单键的能力来感测和成像体外和体内的ONOOˉ。通过对光物理性质的系统研究,证明NBD-Y和NBD-I具有高灵敏度(检测限分别为11和45纳摩尔)、高水溶性(DMSO/PBS = 1:199, v/v)、优异的选择性和对ONOOˉ 的快速响应(3秒内)。其中,NBD-Y成功在活细胞中可视化ONOOˉ,具有良好的细胞膜渗透性和低细胞毒性。此外,NBD-Y还可以用于成像AD大脑中的内源性过氧亚硝酸根,具有良好的BBB穿透性。这些结果不仅表明NBD-Y作为监测过氧亚硝酸根的敏感和可靠探针具有潜力,还可能指导设计用于多个AD模型中ONOOˉ 的新型近红外、双光子和比率荧光探针。
文中应用了广州博鹭腾生物科技有限公司AniView多模式动物活体成像系统分别拍摄了小鼠ONOOˉ活体水平和器官水平的荧光成像。结果显示,WT小鼠脑内荧光在0 ~ 1h ( Fmax / F0 = 3.89)内显著增加,2 ~ 4h内保持稳定。相比之下,APP/PS1小鼠组仅观察到微弱的荧光增强( Fmax / F0 = 1.33 , Fmax和F0分别代表3h和0h时小鼠脑内的荧光强度)。前面体外实验证实AD组和WT组荧光强度的差异主要是由于探针与被激发的ONOOˉ之间的反应。三组小鼠的心脏、肝脏、脾脏、肺和肾脏中几乎观察不到荧光,但在其大脑中检测到明显的荧光变化。这些器官的离体成像结果表明,WT组和姜黄素(CUR)药物处理组的大脑中的荧光强度远高于AD组,证明探针可以穿过血脑屏障并在大脑中检测到ONOOˉ。这些结果证明ONOOˉ的过度表达是阿尔茨海默病的明显标志,并且NBD-Y可以有效地检测大脑中ONOOˉ的表达水平。
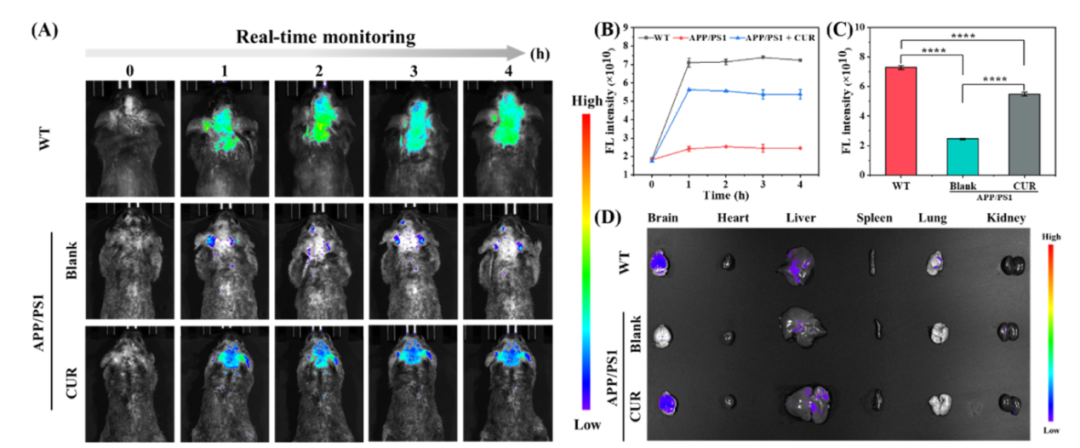
小鼠ONOOˉ活体水平的荧光成像
( A ) 通过尾静脉注射200 μL 0.2mM NBD-Y,在WT、AD以及CUR处理的AD小鼠脑内进行ONOOˉ的活体荧光成像
( B ) 图( A )中小鼠在体荧光强度随时间变化图
( C ) 三组3h荧光强度比较。* * * * P < 0.0001
( D ) 对WT、AD以及CUR处理的AD小鼠的大脑和主要器官进行荧光成像。数据以平均值± SD表示,λex = 435 ~ 495nm,λem = 520 ~ 560nm

论文链接:https://doi.org/10.1016/j.snb.2024.135739