近日,陆军军医大学第一附属医院(重庆西南医院)全军临床病理学研究所卞修武院士、时雨副教授、平轶芳教授团队联合陆军军医大学第一附属医院脑胶质瘤医学研究中心、神经外科李飞副教授、华中科技大学武汉光电国家研究中心张智红教授团队的祁淑红副研究员在胶质瘤血管免疫微环境研究上取得了新进展,相关研究成果已经发表在国际权威期刊《Cancer Cell》(IF=50.3、一区top期刊)上。

肿瘤相关巨噬细胞(TAM),它们大量存在于恶性实体肿瘤中,助长了肿瘤的扩散并制造了一种免疫抑制的环境。目前,科学家们正积极研发针对这些TAM的免疫治疗方法,包括阻断TAM的招募、增强TAM的吞噬、调控TAM的极化和代谢重编程等手段。嵌合抗原受体巨噬细胞(Chimeric Antigen Receptor-Macrophage)疗法等临床试验逐年增加,但是它们的治疗效果和应用价值还相对有限。这是因为TAM来源、在肿瘤内的分布和形态上存在着很大的差异。弄清楚TAM的这种多样性和形成机制是开发针对TAM的新型肿瘤免疫治疗策略的关键。
比如,恶性实体肿瘤内的TAM是由外周单核细胞或脑组织中的小胶质细胞极化而成的。与在肿瘤旁边富集的小胶质细胞来源的TAM(Mg-TAM)不同,单核细胞来源的TAM(Mo-TAM)主要集中在胶质瘤内,而且它们的数量增加与肿瘤复发和患者预后不良有关。不过,胶质瘤内不同空间区域的Mo-TAM是否存在着形态上的差异,以及它们的形成机制尚不清楚。
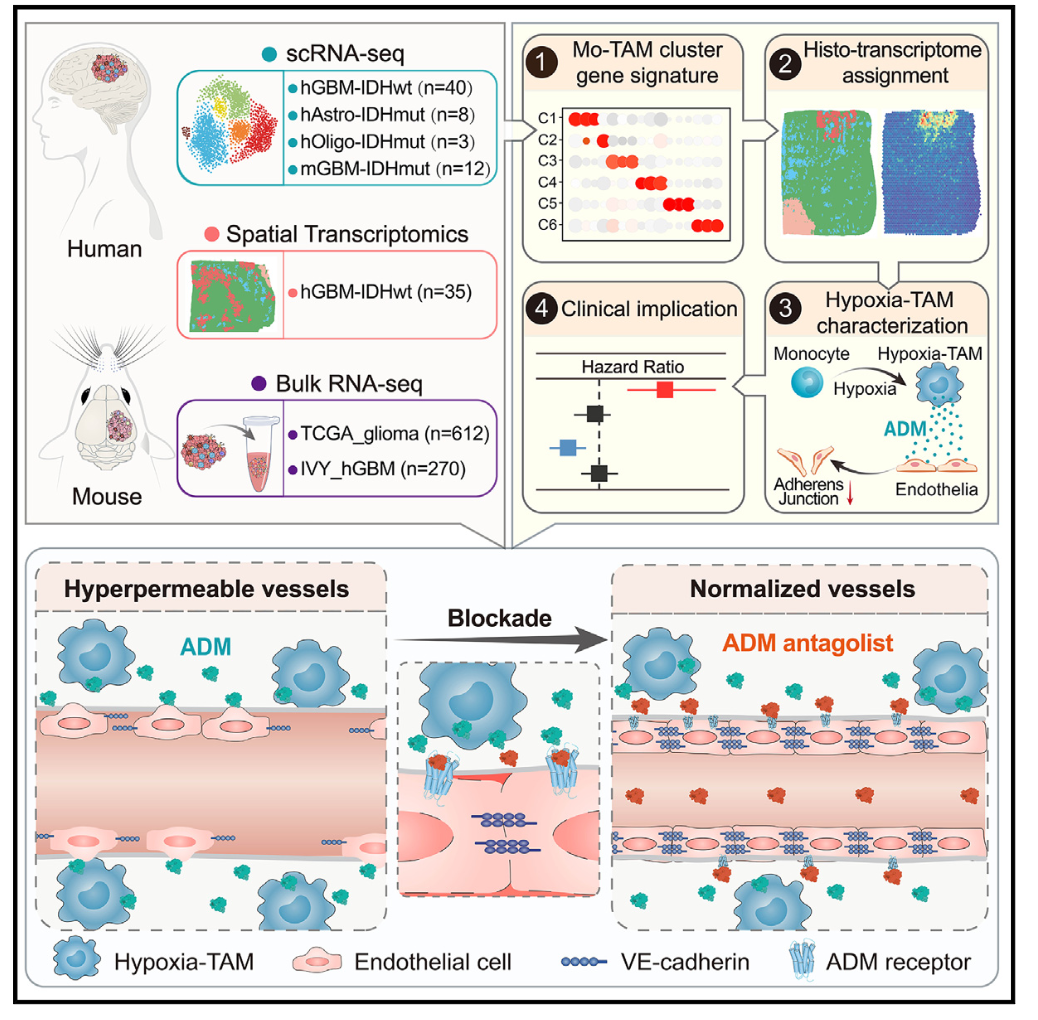
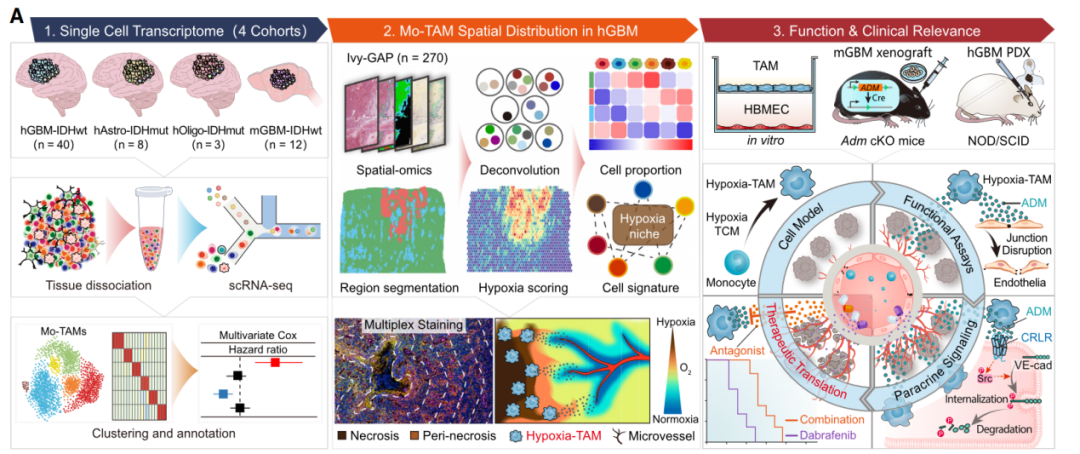
在这项研究中,研究人员通过对51例弥漫性胶质瘤的骨髓细胞进行单细胞和空间转录组学分析,从细胞单个基因和空间位置的角度,描绘出了一张Mo-TAM图谱,并且确定了6种在功能和空间上不同的TAM亚型。这项研究发现了一个名为缺氧-TAM(Hypoxia-TAM)的新亚型,它主要出现在肿瘤的缺氧环境中。缺氧是实体瘤的特征之一,与肿瘤坏死、新血管形成以及各种炎症和趋化因子的产生有关。缺氧信号可能会限制肿瘤和其周围细胞的基因组稳定性、转录适应和代谢模式。此外,缺氧环境可能会增强TAM的招募和免疫抑制性质,从而增加胶质瘤对化疗和免疫治疗的耐药性。因此,研究团队进一步研究了缺氧环境如何影响缺氧-TAM的特征,以及缺氧-TAM如何与其他细胞相互作用以促进肿瘤的发展。
通过综合计算和功能分析,研究人员揭示了缺氧肿瘤信号是如何导致缺氧-TAM极化的。此外,研究还发现缺氧-TAM与人类胶质母细胞瘤(hGBM)坏死区域中不稳定的微血管存在空间关联。进一步的研究表明,缺氧-TAM直接促进肿瘤血管渗漏,并通过过度分泌肾上腺髓质素(ADM)来调节内皮连接的不稳定。ADM已被认为是一种影响心血管系统的肽类激素,调节各种心血管相关的病理生理现象。针对ADM或ADM受体CRLR的药物的治疗潜力预示着治疗心源性休克和偏头痛的可能性。
为了将这些发现应用于临床实践,研究人员评估了ADM拮抗剂(AMA)作为血管正常化剂的潜在治疗价值,以修复内皮连接,从而改善抗肿瘤药物的输送效果。这些研究结果为弥漫性胶质瘤中Mo-TAM的多样性提供了新见解,并阐明了靶向缺氧-TAM的潜在治疗方法,以使肿瘤血管恢复正常。
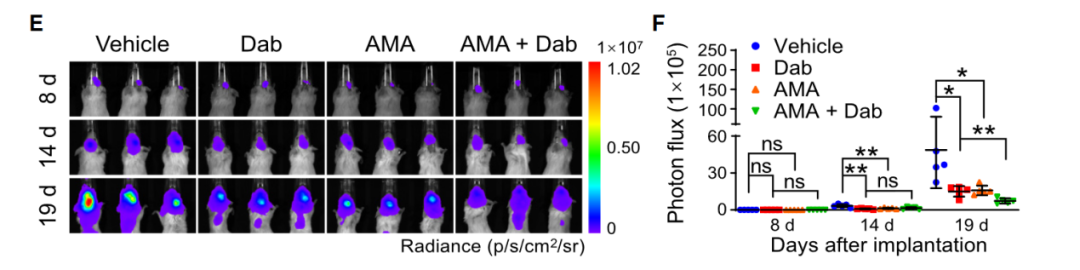
文中,作者使用了广州博鹭腾生物科技有限公司AniView多模式活体成像系统拍摄了不同药物组的荷瘤小鼠肿瘤发光图,证实ADM拮抗剂(AMA)能显著改善抗肿瘤药物的输送效果。
论文链接:https://doi.org/10.1016/j.ccell.2024.03.013